日前,四川汇宇制药以仿制药4类申报上市的多西他赛注射液获批生产,视同通过一致性评价。据米内网统计,截至1月27日,通过或视同通过一致性评价的注射剂有13个受理号(涉及9个品种),其中有3个品种已入选首批“4+7”带量采购,5个品种有望入选第二批带量采购。从目前进展看,注射剂一致性评价总体竞争格局良好,从申报一致性评价及按新注册分类申请上市企业数看,12个品种申报企业数超5家,竞争较为激烈。
9个注射剂已有企业通过或视同通过一致性评价
2017年12月22日,CDE发布《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,虽然只是“技术要求”文件,未明确具体执行时间及节点,但还是引起了业界的轰动。口服制剂一致性评价的阵痛还未结束,注射剂再评价也要来了!
相比于口服制剂,注射剂(不包括缓控释制剂、混悬剂、油剂、脂质体等特殊制剂)在进行一致性评价时无需进行BE试验,因此所花费的金钱较少,但在处方工艺、辅料、包装、工艺控制等方面的要求较为严格,因此通过一致性评价的难度较大。
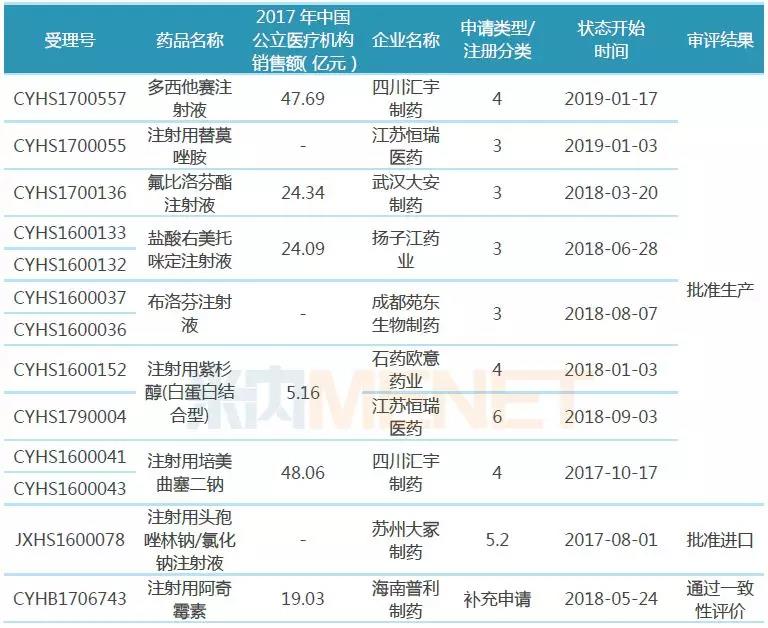
表1:通过或视同通过一致性评价的注射剂
据米内网统计,截至1月27日,CDE承办的一致性评价补充申请受理号已有829个(涉及品种272个),其中属于注射剂的受理号有178个(涉及品种71个);从通过情况看,通过或视同通过一致性评价的注射剂仅13个受理号,涉及品种数9个,涉及企业数8家。
海南普利制药的注射用阿奇霉素是唯一按照一致性评价补充申请并通过的注射剂,其余12个受理号均按新注册分类(仿制药3类、仿制药4类、进口5.2类)申请并获批生产或进口,视同通过一致性评价。
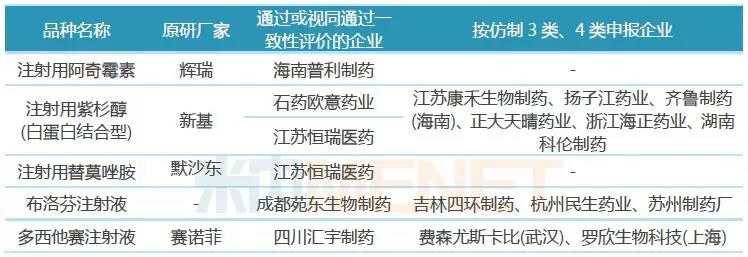
从各品种一致性评价通过情况看,除了注射用紫杉醇(白蛋白结合型)有石药集团欧意药业、江苏恒瑞医药两家企业通过外,其他品种均为独家通过,竞争格局良好;从各品种在2017年中国公立医疗机构终端的销售额看,5个品种为超10亿大品种,替莫唑胺、布洛芬在2017年中国公立医疗机构终端的销售额分别为18.55亿元、10.19亿元,在江苏恒瑞医药、成都苑东生物制药的产品获批生产之前,还未有注射剂在国内上市销售,这2家企业的产品因为按照新注册分类提交上市申请并获批生产,视同通过一致性评价,市场增长潜力大。
3个注射剂入选“4+7”带量采购
表2:“4+7”带量采购中选的注射剂
(来源:上海阳光医药采购网)
2018年12月17日,上海阳光医药采购网发布《关于公布4+7城市药品集中采购中选结果的通知》,25个品种(涉及15家企业)中选,其中有3个品种属于注射剂。
随着一致性评价不断推进,在第二批“4+7”带量采购中,这3个注射剂或将面临更激烈的竞争。目前注射用培美曲塞二钠已有豪森药业、齐鲁制药、扬子江药业提交一致性评价申请,上海创诺制药、费森尤斯卡比(武汉)医药、齐鲁制药(海南)等企业按仿制药4类申报上市;氟比洛芬酯注射液暂未有企业提交一致性评价申请,但重庆药友制药、常州四药制药、山西普德药业、广东嘉博制药等企业已按仿制药3类申报上市;盐酸右美托咪定注射液已有江苏恒瑞医药、江苏恩华药业提交一致性评价申请,此外还有国药集团、石药银湖制药、四川美大康华康药业等企业按仿制药3类申报上市。
表3:有可能纳入第二批带量采购的注射剂
(来源:米内网MED中国药品审评数据库2.0)
2018年9月,“4+7”带量采购网传版流出,共涉及33个通用名药品,注射用紫杉醇(白蛋白结合型)赫然在列,在正式集采文件中,该产品未被纳入。注射用紫杉醇(白蛋白结合型)目前已有2家企业视同通过一致性评价,虽然还没有企业申报一致性评价补充申请,但已有扬子江、齐鲁、正大天晴等6家企业按仿制3类、4类申报上市,竞争非常激烈。
海南普利制药的注射用阿奇霉素在首批带量采购进入到预中标阶段,在最终谈判环节落标,目前该产品没有企业进行一致性评价补充申请,也没有企业按仿制3类、4类申报上市,竞争格局良好。
恒瑞医药的注射用替莫唑胺、成都苑东生物制药的布洛芬注射液均按仿制药3类申报并获批生产,视同通过一致性评价,目前均没有企业提交一致性评价补充申请;近50亿大品种多西他赛注射液目前有江苏恒瑞医药、正大天晴药业提交一致性评价补充申请,费森尤斯卡比(武汉)、罗欣生物科技(上海)等按仿制药4类提交上市申请。
12个注射剂申报企业数超5家
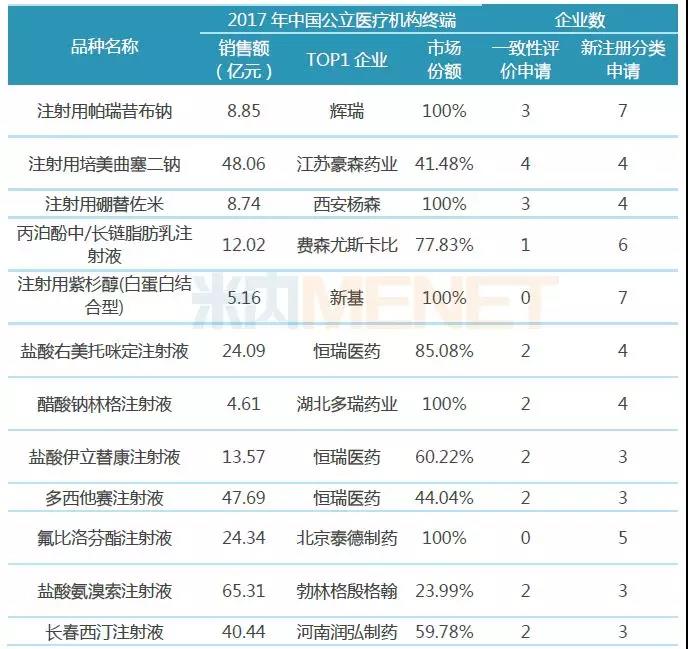
表3:12个注射剂按一致性评价补充申请及新注册分类申报上市企业数超5家
(来源:米内网数据库)
从申报企业数看,有12个注射剂按一致性评价补充申请及仿制3类、4类申报上市的合计企业数超过5家(企业数按集团计),竞争较为激烈,有可能在2019年会有企业通过或视同通过一致性评价,入选第二批“4+7”带量采购。
注射用帕瑞昔布钠以10个企业申请成为最大竞争热点,目前国内市场仅原研厂家辉瑞的产品有上市销售;注射用培美曲塞二钠以8个申请企业紧接其后,该品种已有四川汇宇制药视同通过一致性评价,正在申报一致性评价的齐鲁制药的产品以“同一生产线生产,已于2017年在美国上市”为由纳入优先审评,有望快速通过一致性评价。
“出口转报国内”已经成为国内企业布局一致性评价必选途径,如恒瑞医药,正在申请一致性评价的盐酸伊立替康注射液、多西他赛注射液、盐酸右美托咪定注射液等均已在美国获得ANDA批文,碘克沙醇注射液也于日前在德国获批上市。据米内网数据,2017年中国公立医疗机构终端,这4大品种销售额均超过10亿元,恒瑞医药均占据主要市场份额。
注射用紫杉醇(白蛋白结合型)、氟比洛芬酯注射液这2个品种虽然未有企业处于一致性评价申请阶段,但均有5家及5家以上企业按新注册分类申请上市,从目前注射剂一致性评价通过情况看,绝大多数注射剂是按新注册分类申报上市,获批生产后视同通过一致性评价,这不失为一条抢跑注射剂一致性评价的“捷径”。