透皮贴剂作为一种非侵入性、长效缓释的给药系统,可以满足患者依从性和个体化用药的需求,近年来在新药研发中备受关注。特别是在神经系统、心血管、内分泌等需长期用药的慢性病领域,透皮贴剂不仅可减少胃肠道不良反应,规避首过效应,还能通过简化用药频次、提升患者自主管理能力,显著改善长期治疗体验。
然而,从口服制剂向透皮贴剂的转化远非简单的剂型替换,而是一项涵盖药代动力学重塑、皮肤渗透调控、剂量等效性验证等多重挑战的系统工程。药物改良研发过程中,临床药理研究承担着关键桥梁作用——它贯穿于药效评估、给药方案优化与历史数据桥接的全过程,是推动改良药从科学构想到临床落地的核心环节。
面对复杂的技术难点与法规要求,如何系统开展临床药理研究、有效支持注册申报,已成为企业布局透皮贴改良药物必须攻克的首要课题。

在现行注册监管制度下,改良型新药要以“明显临床优势”为核心评价导向,从提高依从性、改善安全性、提高有效性三个维度满足注册审批要求。口服制剂改透皮贴剂,通过剂型改良的技术路径回应未被满足的临床需求,是该类改良型新药实现注册准入的关键所在。其临床优势主要体现在两个方面:
提高依从性:透皮贴剂具备无创、无痛、可自助给药的特性,能够显著降低给药频次(延长给药间隔),有效规避口服给药途径可能引发的吞咽障碍等问题,尤其适用于儿童、老年患者及吞咽困难人群,可切实提升长期治疗过程中的用药依从性。
改善安全性:透皮给药可使药物不经胃肠道吸收,可能减少胃肠道相关不良反应(如恶心、呕吐、黏膜损伤等)的发生。对于需长期进行慢病管理的患者而言,该剂型可显著降低药物慢性毒性累积的风险,提高长期用药的安全性。
剂型改良的临床开发策略
在临床研究阶段,针对不同临床优势目标的改良路径存在差异,具体开发策略也有不同侧重。
(一)以“提高依从性”为目标的开发策略
立题评估阶段,需同时满足注册审批中“显著临床优势”的三项核心要求:一是被改良制剂是否为该适应症的临床常用药物(即标准治疗药物),且其安全有效性证据充分明确;二是剂型改良后是否不降低原制剂的治疗有效性,且不增加新的安全性风险;三是临床中是否存在明确的用药依从性问题,且该问题可通过本次剂型改良得到有效解决[1]。
在口服改透皮贴剂的剂型改良过程中,临床药理研究不仅是证明药物在体内行为一致性的科学基石,更是高效推进临床开发的关键引擎。通过系统的药代动力学对比研究,可清晰呈现新剂型与原制剂在暴露特征上的等效性或可接受范围内的差异,从而为后续临床阶段的设计提供扎实依据,甚至可能帮助申办方合理省略剂量探索阶段,大幅加速研发进程。
2022年获批的多奈哌齐透皮贴剂,正是凭借严谨的临床药理研究,在未开展大规模II/III期试验的情况下,通过多项I期研究成功论证其与口服片剂的生物等效性,最终实现以“提升患者依从性”为核心价值的改良目标(1次/日的口服片剂改为1次/周的透皮贴剂),顺利获批上市。
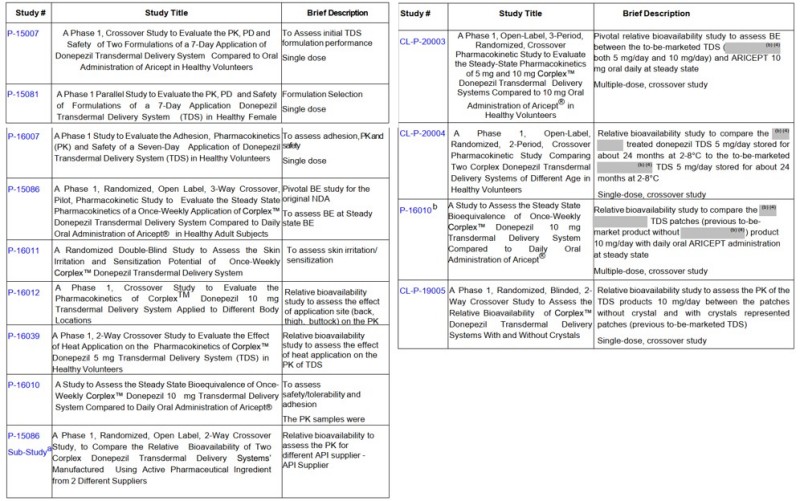
图1:多奈哌齐透皮贴剂临床研究列表
(来源于NDA212304 Clinical Pharmacology Review)
(二)以“改善安全性”为目标的开发策略在立题评估阶段,需明确3个关键问题:一是被改良制剂是否已成为该适应症的临床常用药物(即标准治疗药物),且具备充分的安全有效性证据;二是原制剂是否存在临床上不可忽视的安全性风险,且该风险已显著影响其临床应用合理性;三是改良方案是否基于明确的机制研究或非临床证据,具备改善此类安全性问题的科学可行性。
通过系统的临床药理及早期探索性研究,可科学筛选出既能维持疗效、又能有效规避原有安全性风险的优化给药剂量与方案,为后续III期临床试验的设计提供关键依据。在III期临床阶段,需在与原制剂的对照中,证实改良剂型在有效性上达到等效或非劣效,同时在安全性问题上实现具有临床意义的改善,且未引入新的风险。
以2006年FDA批准的哌甲酯透皮贴剂为例,其针对中枢兴奋剂哌甲酯的高成瘾风险,在缓释片基础上进行了剂型创新。该贴剂每日使用一次,但贴敷时间限制在9小时以内,从而通过控制夜间药物暴露,显著降低了相关不良反应发生率,实现了明确的安全性优化。在这一过程中,临床药理研究并未简单桥接原给药方案,而是通过完整的I、II、III期研究,逐步验证了其在药代动力学特征、安全性与疗效之间的科学平衡,最终推动该剂型成功上市。
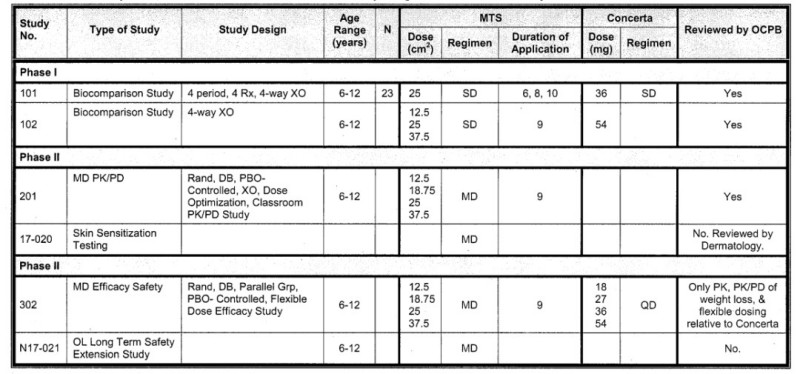
图2:哌甲酯透皮贴剂临床研究列表
(来源于NDA21514 Clinical Pharmacology and Biopharmaceutics Review)临床药理研究设计要点
剂型改良的核心原则,是明确新剂型与原剂型在药物暴露特征上的差异,先通过研究验证二者暴露特征的可比性,再基于该结果确定后续临床研究的给药方案及关键设计要素。新剂型与原剂型的药代动力学特征越相近,可桥接的临床数据范围越广,所需补充开展的临床试验数量越少。
该类药物临床药理研究的核心设计要点如下:
规格选择:通过药代动力学研究,从多种备选规格中筛选出药代动力学特征最符合预期的规格,该筛选过程通常可在前期预试验阶段完成确认。
给药部位选择:与口服制剂不同,外用贴剂的给药部位会直接影响药物的药代动力学特征。背部、上臂、胸部等部位的皮肤厚度、血流速度、脂质含量存在显著差异,进而导致药物吸收效果不同。对于需长期用药的外用贴剂,应系统评估不同给药部位的药物吸收差异,明确是否允许轮换给药部位。该研究可在多次给药PK研究前或III期临床试验前完成。例如,2003年FDA批准的奥昔布宁透皮贴剂,其不同给药部位研究结果显示,腹部、臀部、髋部的体内药物暴露量具有一致性,允许在上述三个部位轮换给药,因此其说明书明确标注“应用于腹部、臀部或髋部干燥且完整的皮肤,每片新贴剂需更换至新的部位”。
黏附性评估:贴剂脱落会直接导致给药剂量不足,影响治疗效果。FDA相关指导原则明确要求,外用贴剂类新药需开展黏附性评估,以确保给药过程中剂量的准确性,但我国目前尚未出台相关专项指导原则。建议在I期临床试验阶段即开展黏附性试验,该试验可独立进行,也可与PK试验同步实施。
刺激性评价:外用贴剂需重点关注给药部位的刺激性问题。NMPA于2025年11月发布了《化学仿制药透皮和局部给药系统黏附性和刺激性/致敏性评估的临床试验技术指导原则(征求意见稿)》,预示我国将进一步规范外用制剂的黏附性和刺激性临床评价标准。刺激性评价试验可独立开展,也可与PK试验同步进行。
加热影响研究:对于贴敷时间超过24小时的长效贴剂,日常洗澡的热水、老年人群常用的电热毯等外部热源是否会增加药物吸收,进而引发安全性风险,是临床研究需重点关注的问题。例如,用于治疗轻、中、重度阿尔茨海默病型痴呆的多奈哌齐透皮贴剂,考虑到其用药人群以老年人为主,专门开展了加热影响试验,结果显示加热条件下药物体内暴露量显著增加,因此其说明书明确规定“需避免长时间暴露于外部热源(如过量阳光照射、桑拿房、日光浴室或加热垫等)”。该研究可在III期临床试验前完成,或与III期临床试验同步开展。
采血点设计:贴剂移除后,皮肤角质层仍作为药物储库持续释放药物,因此采血过程需持续至血药浓度降至基线水平,以避免低估药物的系统暴露量,确保研究数据的准确性。
剂型改良是延长新药市场生命周期常用且高效的研发策略。
在临床研发过程中,其核心逻辑根植于深入的临床药理研究——通过系统对比新剂型与原剂型在药物暴露特征上的差异,明确其生物等效性或暴露量可接受范围,从而为后续临床研究的关键设计,如给药方案、剂量选择和试验阶段衔接,提供科学依据与决策支持。临床药理研究不仅是桥接药学与临床疗效的重要环节,也是优化研发路径、提升开发效率的基石。
晶易医药在外用贴剂类药物研发领域具备深厚的技术积累与丰富的项目经验。作为专注于该类剂型改良的CRO,公司已成功推进多个口服制剂改外用贴剂的改良型新药项目,构建了从前期立题论证、临床药理研究到临床方案设计与实施的全链条一站式解决方案,能够为改良型新药提供专业、系统的临床研发策略支持。
[1]改良型新药研发沟通交流中的临床关注点(药审云课堂--第五期--孙艳喆老师).
[2]NDA212304,FDA Clinical Pharmacology Review.
[3]NDA21514,FDA Clinical Pharmacology and Biopharmaceutics Review.


