《中华人民共和国药典》2020年版四部贴剂通则中关于贴剂和透皮贴剂的描述如下:贴剂系指原料药物与适宜的材料制成的供贴敷在皮肤上的,可产生全身性或局部作用的一种薄片状柔性制剂。贴剂可用于完整皮肤表面,也可用于有疾患或不完整的皮肤表面。其中用于完整皮肤表面能将药物输送透过皮肤进入血液循环系统起全身作用的贴剂称为透皮贴剂。

透皮贴剂用法示意图
由于人口老龄化以及慢性病患者对于更简单便捷给药方式需求的增加,透皮贴剂依靠其独特的剂型优势,具有越来越广阔的市场前景。原研产品的专利到期后,开发高质量、安全、有效的仿制药能使更多患者受益。透皮贴剂生物等效性试验要求和操作难点
我国目前尚未发布透皮贴片人体生物等效性试验的相关指导原则。根据FDA颁布的透皮贴剂仿制评价指南及个药BE指南,申办单位除了需进行以PK参数为评价指标的生物等效性研究外,还需对透皮贴剂的粘附性、刺激性、致敏性进行评估。
TDDS中药物通过皮肤吸收是一个复杂的途径,包括通过表皮、真皮的渗透和或通过汗腺、皮腺、毛囊等皮肤附属物吸收。
透皮贴剂通常由背衬层、活性层、接触式胶黏剂以及在使用前移除的保护层组成,根据活性层的结构特点分为骨架型和储库型。无论哪种类型,若不能保持在皮肤均匀附着,如出现边缘卷起甚至脱离皮肤时,透皮贴剂与皮肤接触的表面积以及潜在的药物输送量都会减少,体内PK暴露量会随之发生改变。因此,透皮贴剂的生物等效性试验,除PK-BE外还需进行粘附性评估。
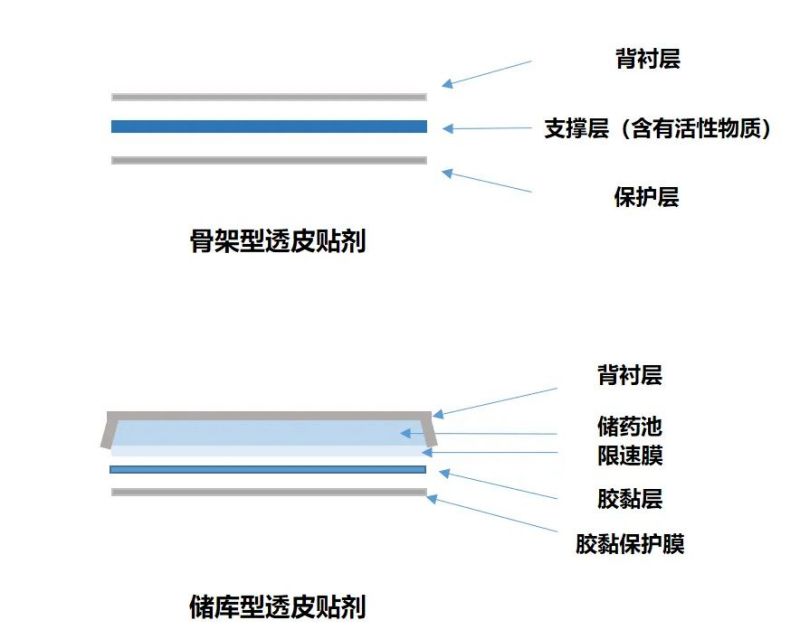
透皮贴剂结构示意图
因此,影响透皮贴剂生物等效性试验的因素复杂多样,除与贴剂本身以及受试者生理因素有关外,也与试验过程中环境的温湿度、光照程度、贴敷部位及黏附性、受试者活动量等有关。复杂的评价要求和影响因素,对透皮贴剂的生物等效性试验设计和控制提出了较高要求。透皮贴剂BE经验优势
截至目前,晶易医药已开展了近1000项BE临床项目,其中包括罗替高汀透皮贴剂、雌二醇透皮贴剂、格拉司琼透皮贴剂、东莨菪碱透皮贴片等多个透皮贴剂品种的BE试验。研究团队已掌握了透皮贴剂BE试验的关键要点,在项目开展过程中摸索并建立了关于给药、受试者管理、环境管理等一系列SOP,以确保项目顺利进行。
[1]由春娜,宋宗华,张启明,等.透皮贴剂仿制药研发和监管考量[J].中国新药杂志,2020,29(24):8.
[2]孙华,梁大虎,李相鸿,等.透皮贴剂生物等效性研究的评价方法与实施要点[J].中国新药杂志,2021,30(24):7.DOI:10.3969/j.issn.1003-3734.2021.24.009.


