根据FDA个药指南及CDE(国家药品监督管理局药品审评中心)建议,需进行体外溶出研究、磷酸盐动力学结合研究和磷酸盐平衡结合研究,以及体内临床药效终点研究,来评价受试制剂和参比制剂生物等效性研究。
截至目前醋酸钙、碳酸镧咀嚼片或颗粒、碳酸司维拉姆干混悬剂国内已有多个厂家通过一致性评价,但枸橼酸铁片目前国内还未有仿制药上市。该品种体外磷结合等效性评价的方法是非常关键的部分,但该研究具体有哪些挑战及关键注意事项?本文将结合指导原则要求与我司前期经验进行具体讨论与分析。
一、体外磷酸盐结合等效性评价标准
FDA及CDE颁布的指导原则中,不同磷结合剂的体外等效性评价标准汇总如下:

▍复杂代谢路径
枸橼酸铁在胃肠道中主要通过局部结合磷酸盐发挥作用,而非系统性吸收,传统血药浓度检测方法难以直接评估其生物等效性。
▍替代指标选择
需依赖体外磷酸盐结合能力、铁释放速率等替代参数,结合临床终点(如血磷下降幅度、铁代谢指标)进行综合判断。
▍方法学局限性
体外试验无法完全模拟人体胃肠环境(如pH波动、食物成分干扰),需通过多批次重复试验和交叉验证提高数据可靠性(要求至少n=12)。
▍支持监管申报
FDA和EMA、NMPA均要求提交体外结合试验数据作为仿制药开发的必要证据,以证明与原研药的理化特性一致。
三、实验设计研究要点
▍磷酸盐浓度
结合试验应至少包含8个不同的磷酸盐浓度,包括达到结合平台的最高磷酸盐浓度,约最高磷酸盐浓度1/10的最低磷酸盐浓度,以及介于最高和最低之间的其余磷酸盐浓度。
▍磷酸盐动力学结合研究测定时间点
每个条件下应在24 h内选择至少8个时间点。需特别注意达到平台期前的时间点不能太少,以反映受试制剂和参比制剂动力学变化趋势。
▍磷酸盐平衡结合研究浓度和孵育时间
平衡研究磷酸盐的浓度需结合正常体内每天摄入磷酸盐量,制剂规格,溶液体积等综合评定。孵育时间根据动力学达到稳态的时间进行合理选择。
▍pH监控
对于动力学和平衡试验都需要提供详细的pH监控方法、记录、间隔时间等。
四、实验设计研究要点
重点参考中国药典9012《生物样品定量分析方法验证指导原则》,需要考察系统适用性、定量限、准确度、精密度、稀释可靠性、耐用性、残留、基质效应、膜吸附、稳定性等,以验证方法准确可靠。
干扰考察:如加入了BES等pH稳定剂来配制磷酸盐,还需要考察BES对磷酸盐结合的影响,另外还需要考察辅料、原料药、空白制剂对磷酸盐检测的干扰。
建议进行ISR研究,以考察方法的准确性。
所有资料都需要按照等效性评价相关要求提供,如制剂来源、质检报告,分析计划、分析报告、进样序列表、标曲质控汇总表等。
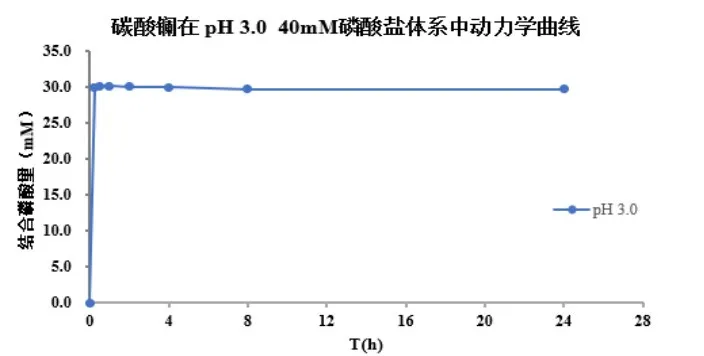
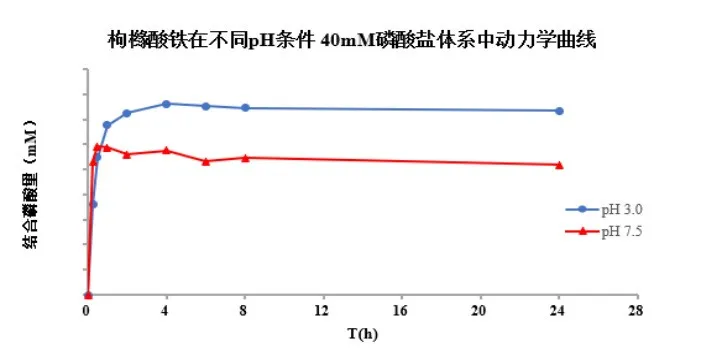
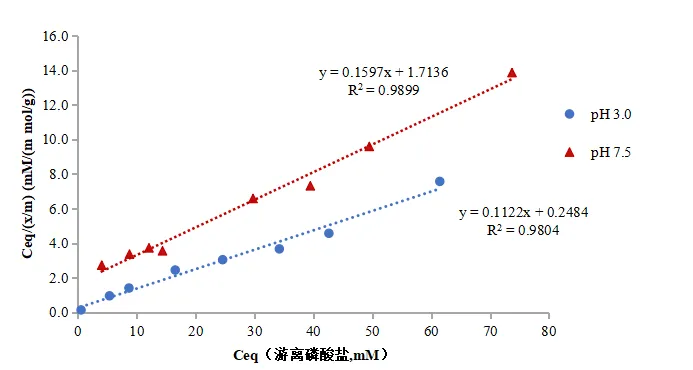
五、体外磷结合药动学及平衡研究曲线
六、体外磷结合研究其他应用
除了抗高磷血症药物外,对于可能导致低磷血症的补铁剂(如蔗糖铁、羧基麦芽糖铁),也可以通过体外磷结果试验评估药物与磷酸根的结合能力,从而预测其在体内引起低磷血症的风险,为临床用药提供安全性依据。
湖南科锐斯医药的磷酸盐动力学和磷酸盐平衡结合研究平台,已成功开发了碳酸镧咀嚼片、枸橼酸铁片分析方法,并已经助力客户完成该品种体外磷酸盐等效性评价研究。

专业团队:以高级工程师领衔的核心骨干团队成员56人,本科及以上比例100%,硕士及以上占比41%。
质量体系:取得中国合格评定国家认可委员会(CNAS)实验室认可证书。实验过程采用电子化信息系(LIMS)统进行全流程的记录管理和生物样本管理,并建立了满足中美双报的中英文体系。
特色品种:
外用制剂:洛索洛芬钠凝胶贴膏、丙酸氟替卡松乳膏等
复方制剂:复方甘草酸苷等
内源性物质:熊去氧胆酸、二十碳五烯酸等
体外磷结合剂:枸橼酸铁等


