婴幼儿时期是湿疹、特应性皮炎、接触性皮炎等炎症性皮肤疾病的高发阶段,但针对婴幼儿这一特殊群体的外用糖皮质激素类药物选择却非常有限,目前国内相对安全有效的仅有0.05%地奈德乳膏。许多药品的说明书缺乏婴幼儿用药的权威数据,导致用药时常陷入“疗效与安全”的两难抉择:强效药物可能有系统性吸收带来的生长抑制等风险,而弱效药物又可能无法有效控制病情。因此,研发和推广更多适用于婴幼儿的、安全性更高的外用糖皮质激素制剂,是儿科皮肤病学领域亟待解决的重要课题。
根据抗炎强弱,外用糖皮质激素药物可分为四大类:
弱效激素包括地奈德乳膏、醋酸氢化可的松等,适用于轻度及中度皮损(包括儿童皮肤病、面部和皮肤柔嫩部位),可以短时较大面积使用,必要时可以长期使用。
中效激素如糠酸莫米松乳膏和洗剂、丙酸氟替卡松乳膏等,适合轻中度皮损,可以连续应用4-6周;小于12岁儿童连续使用尽量不超过2周;不应大面积长期使用。
强效激素包括哈西奈德乳膏、去羟米松软膏剂及乳膏等,超强效激素则以丙酸氯倍他索为代表,超强效激素和强效激素适用于重度、肥厚性皮损。一般每周用药不应超过50g;连续用药不应超过2-3周;尽量不用于小于12岁儿童;不应大面积长期使用;除非特别需要,一般不应在面部、乳房、阴部及皱褶部位使用[1]。
尽管外用糖皮质激素疗效显著,但长期、大量、不恰当使用会产生一系列副作用,使其成为一把“双刃剑”。例如:对于儿童及孕妇用药风险,可能产生全身系统性风险,导致下丘脑-垂体-肾上腺轴抑制;长期使用易导致皮肤萎缩、毛细血管扩张、色素沉着、痤疮样皮疹,强效药更易引发风险等。
因此,提升疗效和安全性,提高其对湿疹高发人群——婴幼儿的适用性,以及疗程的灵活性,是外用糖皮质激素类创新制剂开发的重要方向。
在糖皮质激素外用制剂新药早期探索中,临床试验研究的重点是什么?
FDA针对外用糖皮质激素新药I期研究的核心内容,可归纳为“效价确定研究、局部安全性/耐受性研究、系统暴露研究”三大模块。
1效价确定采用血管收缩试验,与已上市的不同效价的外用糖皮质激素类药物进行皮肤变白效果的对比,从而确认试验药物的效价。
基于皮质激素类药品可使皮肤变白或收缩皮肤微血管这一性质,R.B.Stoughton博士与A.W.McKenzie博士,建立了评价不同外用皮质激素类药物作用强度的方法[2]。该方法可以可靠的预测外用皮质激素类药物的临床效果,加速外用皮质激素类药物的开发进程[3]。
目前FDA通过审评的外用皮质激素类药物效价测定主要有3种形式:
在受试者不同皮肤位点分别使用试验药物和已知效价的对照药物,敷药持续某一固定时间后,擦除药物,对不同位点的皮肤变白强弱进行目视评分或测光仪测定,进而评价试验药物相对于对照药物的效价强弱。
先开展皮肤变白效应指标的剂量探索研究,得出试验药物达到半数最大作用的剂量(ED50),再在受试者不同皮肤位点分别使用试验药物和已知效价的对照药物,给予ED50剂量后,擦除药物,对不同位点的皮肤变白强弱进行目视评分或测光仪测定,进而评价试验药物相对于对照药物的效价强弱。
对试验药物和对照药物均分别开展皮肤变白效应指标的剂量探索研究,通过对比试验药物与对照药物的ED50、Emax,评价试验药物相对于对照药物的效价强弱。
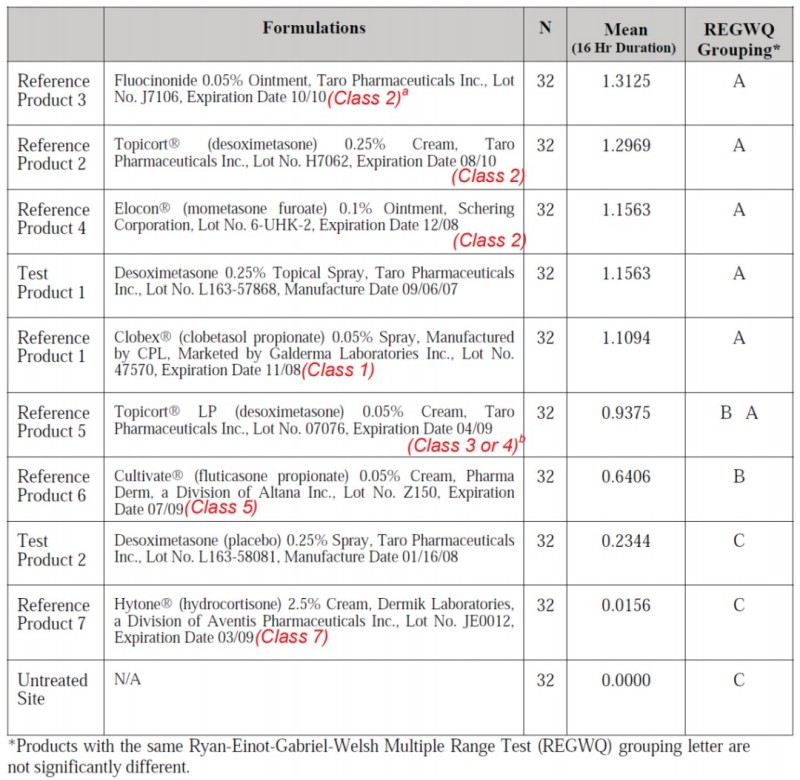
以上3种通过人体皮肤变白试验评价试验药物的方法中,以第1种最为常见,其常见的方案为:在受试者不同皮肤位点分别使用试验药物和已知效价的对照药物,持续16小时后,擦除药物,对擦药后2小时的皮肤变白情况进行目视评分或使用仪器进行皮肤色度测定。对目视评分或仪器测定数据使用Ryan-Einot-Gabril-Welsch Multiple Range Test(REGWQ)进行两两比较,评估试验药物的效价。
效价测定结果示例[4]
外源性糖皮质激素通过负反馈机制抑制下丘脑CRH和垂体ACTH的分泌,从而降低内源性皮质醇水平。HPA轴抑制试验是评估糖皮质激素系统性暴露安全性的关键工具,尤其用于新药研发中HPA轴抑制风险的量化。其核心目的是判断药物在“最大使用条件”下对HPA轴的负反馈抑制程度,为药品剂量、疗程及警示语提供直接证据。试验可以纳入健康受试者或者患者,需选最高拟定浓度,qd或bid,连续给药2-4周;必要时加封闭敷料模拟极端情况。评估指标为血清皮质醇浓度和ACTH水平。
3系统暴露研究主要有单次给药递增试验(SAD)+多次给药递增试验(MAD),MAD通常需覆盖预期临床最大使用强度。
简言之,FDA针对外用糖皮质激素新药的I期临床方案就是“最大皮肤给药+最敏感人群”,用HPA轴抑制和系统PK作为终点,同时完成局部耐受与血管收缩效力评估,为后续II期剂量选择、给药方法提供定量依据。
对比国内,当前尚无可参考的相关指导原则和审评案例。作为在外用糖皮质激素类药物领域具备开创性研究的CRO,晶易医药临床团队深度对标FDA标准,构建了从皮肤吸收PK/PD到系统暴露量研究的全链条、一站式解决方案,能够为该类新药提供临床研究路径规划参考。也期待国内研究和监管早日完善,为新药提供坚实的临床药理依据,加速创新成果惠及全球患者。


