

01 | 研究背景
心血管疾病(CVD)是全球范围内威胁人类生命健康的最主要的慢性非传染性疾病,动脉粥样硬化性心血管疾病(ASCVD)为主的CVD(如缺血性心脏病和缺血性脑卒中等)是我国城乡居民第1位死亡原因,占死因构成的40%以上[1]。低密度脂蛋白胆固醇(LDL-C)升高是公认的CVD独立危险因素,由于他汀类药物能够有效降低LDL-C水平及心血管事件风险,现已成为防治CVD的基石。然而,经包括他汀类药物治疗使LDL-C达标在内的传统危险因素管理后,患者仍存在发生大血管或微血管事件的风险,即CVD残余风险。近年来多项流行病学、机制以及人群干预等研究提示,甘油三酯(TG)水平升高与CVD存在一定关联,是他汀类药物治疗后CVD残余风险的重要因素[2]。二十碳五烯酸乙酯是一种ω-3多不饱和脂肪酸,能够抑制坏脂蛋白的作用,减少在血管内壁上的附着沉积,而且能协助高密度脂蛋白胆固醇(HDL-C)清除血管壁上多余的脂肪。2012年7月26日,美国食品与药物管理局(FDA)批准Amarin制药公司的二十碳五烯酸乙酯软胶囊(商品名:Vascepa)用于治疗高甘油三酯血症,成为市场上第二个ω-3多不饱和脂肪酸处方药。同时,二十碳五烯酸乙酯是FDA批准的唯一一个最大耐受剂量他汀类药物的辅助用药以及首个获批能有效降低残余心血管事件发生风险的药物。
02| 品种基本情况

参考FDA于2022年11月修订发布的《二十碳五烯酸乙酯软胶囊生物等效性研究指导意见(草案)》,推荐了两种类型研究:第一种是体外试验;第二种是以PK参数为终点评价指标的BE研究。下文将结合个药指南对本品生物等效性研究的关键点进行分析[3]。
1. 研究类型
FDA个药指南建议采用部分重复或完全重复交叉设计,以4g的单次给药剂量进行空腹和餐后给药条件下的生物等效性研究。
二十碳五烯酸乙酯为二十碳五烯酸(EPA)的前体药物,口服后被酯酶迅速水解为EPA,EPA水溶性较差,其吸收依赖胆固醇、磷脂等胆盐乳化后形成可溶性胶束被小肠上皮细胞摄取进入体循环吸收。文献报道EPA个体内变异可达60%[4],相比于餐后试验,空腹条件下参与乳化的胆盐更少导致吸收较差,个体内变异更高。因此重复交叉设计符合本品生物等效性评价目的,可降低试验失败风险。
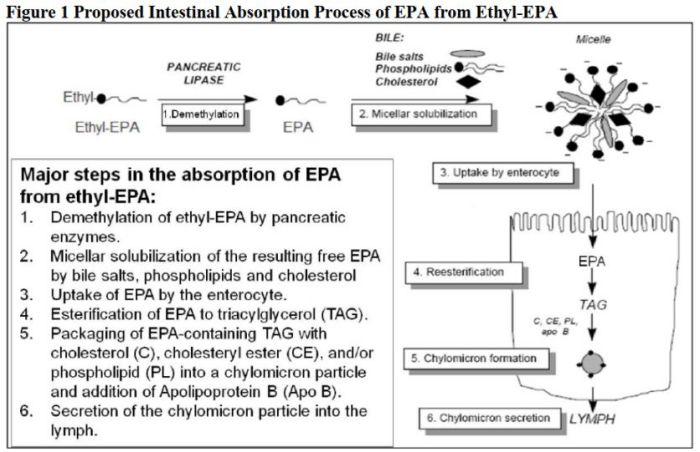

根据原研说明书,本品在给药后约5小时达到血浆峰浓度,文献数据显示,个体达峰时间范围在7-36小时,整体吸收较为平缓,可在达峰时间附近稍密集采血。平均半衰期约89小时,采血至给药后288小时满足不少于3个半衰期要求。此外,根据FDA个药指南要求,还需要从给药前24小时至0小时(含0小时)之间收集三个或更多(>3个)样本,以这些点的平均血药浓度值来计算基线值并进行扣除。
3. 检测物质
循环系统中血浆内大部分EPA参与构成磷脂、甘油三酯、胆固醇酯,小于1%以未酯化的脂肪酸形式存在。FDA个药指南推荐对血浆中的总EPA和游离EPA血药浓度进行测定,因此本品的检测物质为血浆中的总EPA和游离EPA。
4. 生物等效性评价
以基线校正后的总EPA作为本品生物等效性评价的指标,提交基线校正后的游离EPA结果作为支持性数据。对于适用RSABE(即参比制剂的个体内变异CVw≥30%)评价方法的生物等效性评价指标,其单侧95%置信区间上限应小于等于零,同时受试制剂与参比制剂的几何均值比的点估计值应在80.00%-125.00%范围内。
5. 其他考虑
本品为内源性药物,FDA个药指南建议从给药前至少48小时到给药后至少36小时控制受试者的饮食,并在饮食控制期间限制EPA的摄入。餐后试验高脂餐应高脂、高热量,但不含EPA。日常饮食中多种食物含有EPA,如海洋鱼类、贝类、海洋鱼油及其制品等,试验过程中饮食管理是本品等效的因素之一。
二十碳五烯酸乙酯作为首个经高质量循证证据证实可降低心血管风险的降TG药物,打破了既往血脂管理“唯LDL-C”的观念。《中国血脂管理指南》(2023年)基于循证结果也积极推荐二十碳五烯酸乙酯软胶囊用于ASCVD伴TG升高(>2.3 mmol/L)的患者以降低ASCVD风险。
因其高变异、长半衰期、内源性等问题,对方案设计和试验过程中的管控提出了高要求。如何筛选适宜的受试者有效降低基础EPA水平对结果的干扰;避免食源性EPA摄入影响入血量;较长的采血期和清洗期如何提高受试者依从性;生物样本检测需排除基质干扰,提高回收率等。
作为国内早期进行本品生物等效性研究的CRO,我司在受试者储备招募、试验方案设计、试验现场管理以及血浆样本处理分析等方面均积累了丰富的经验,正式试验已取得等效结果,可助力申办方快速推进二十碳五烯酸乙酯软胶囊的BE研究。
[1]中国血脂管理指南,2023年。
[2]李勇,甘油三酯升高的心血管疾病高危患者应用高纯度二十碳五烯酸制剂的临床意义,中国循环杂志2022年11月第37卷第11期。
[3]FDA Draft Guidance on Icosapent Ethyl November 2022.
[4]J.-F. Lapointe et al, A Single-dose, Comparative Bioavailability Study of a Formulation containing OM3 as Phospholipid and Free fatty Acid to an Ethyl Ester Formulation in the Fasting and Fed States, Clinical Therapeutics January 30, 2019.
供稿:晶易医药解决方案部


